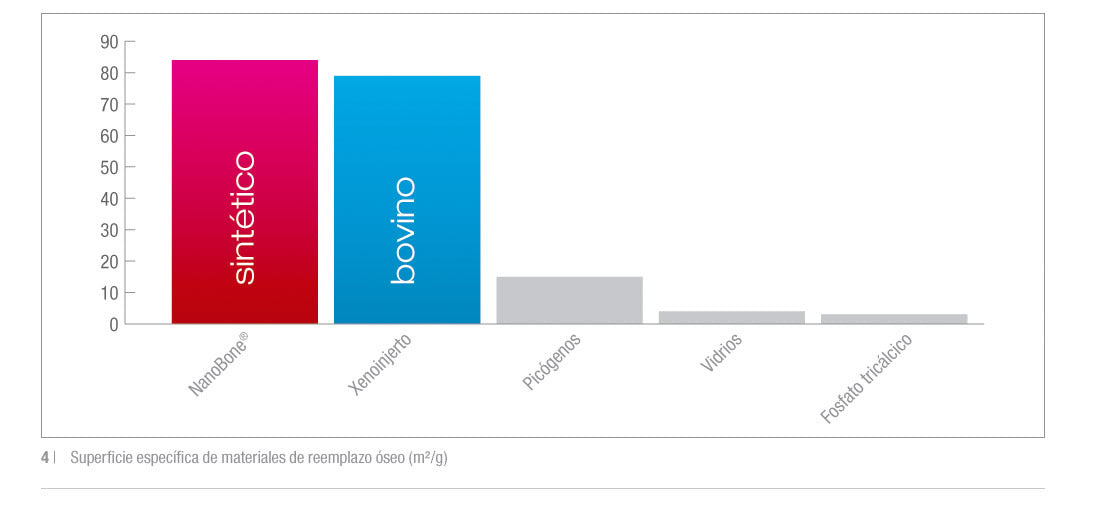
Los nanoporos de interconexión y la HA nanocristalina son las claves del éxito. Gracias a su porosidad en escala nanométrica, NanoBone® tiene una gran superficie para alcanzar nuevas dimensiones.
FORMACIÓN DE HUESO MÁS RÁPIDA
Durante el proceso natural de formación y reabsorción ósea –el remodelado– nuestro hueso está en constante regeneración. NanoBone® participa activamente en esta remodelación y por tanto actúa como factor de crecimiento del proceso natural.
El secreto del éxito es la eficiencia de su nanoestructura: hidroxiapatita (HA) nanocristalina, que como elemento principal de hueso autógeno está embebido en una matriz altamente porosa de gel de sílice. Este gel de sílice estimula la formación de colágeno y de hueso.
La especial estructura de NanoBone® es la clave para conseguir una formación ósea tan rápida. Los estudios clínicos demuestran que, en casos de elevación sinusal, se puede conseguir un soporte estable para un implante a los 3 meses. Otros materiales de reemplazo óseo necesitan un plazo de 9-12 meses en casos similares. Esto explica que el uso de NanoBone® ayuda en una reducción significativa de la duración del tratamiento.
Meier y colaboradores han demostrado que después de tres meses fueron detectados 37,7% hueso, 43,0% de esponjosa y sólo un 19,3% de NanoBone®. En este contexto, la osteogénesis angiogénica de NanoBone® constituye una diferencia real en calidad. Para otros materiales de injerto óseo sólo fue detectada formación ósea en el borde del defecto.
COMPLETA REMODELACIÓN
Contando con el componente de HA que es idéntico a la naturaleza y que la matriz orgánica se ha formado en tan poco tiempo (cambio de la matriz de gel de sílice), el cuerpo identifica a NanoBone® como un material compatible y comienza el proceso de formación ósea natural –la remodelación–. Los osteoclastos fagocitan los gránulos. Al mismo tiempo los osteoblastos forman hueso autólogo.
Durante el proceso NanoBone® es completamente sustituido por hueso de manera que al contrario de lo que sucede con los materiales de injerto xenogénicos no hay sustancias residuales extrañas que puedan influir la biomecánica natural. Considerando el hecho que una porción de aproximadamente un 16% deestos materiales de reemplazo pueden ser detectados después de 10 años, el remodelado completo de NanoBone® constituye una ventaja decisiva.
GRAN RESULTADO A TRAVÉS DE LA NANOESTRUCTURA
Los nanoporos de interconexión y la HA nanocristalina son las claves del éxito. Gracias a su porosidad en escala nanométrica, NanoBone® tiene una gran superficie para alcanzar nuevas dimensiones.
INDICACIONES
IMPLANTOLOGÍA

CIRUGÍA FACIAL Y MAXILOFACIAL
Reconstrucción del reborde alveolar
Relleno de defectos post-trauma

PERIODONCIA
Relleno de defectos óseos de 2 ó más paredes.
Defectos de Furca

MANIPULACIÓN DE NANOBONE® GRÁNULOS
Los gránulos de NanoBone® tienen que estar en contacto directo con el hueso vital, por ello la mezcla con sangre del propio paciente aporta las proteínas necesarias para la formación ósea, la hidratación con suero fisiológico es también indicada y el defecto óseo tiene que ser rellenado completamente con los gránulos.

CIRUGÍA FACIAL Y MAXILOFACIAL
Reconstrucción del reborde alveolar. Relleno de defectos post-trauma

ESTUDIO COMPLETO
OBJETIVOS
Los nanoporos de interconexión y la HA nanocristalina son las claves del éxito. Gracias a su porosidad en escala nanométrica, NanoBone® tiene una gran superficie para alcanzar nuevas dimensiones.
MÉTODO
En cada uno de los seis conejos, se realizaron cuatro defectos bicorticales en la calota. Las cuatro siguientes modalidades fueron aleatoriamente seleccionadas: (1) sitio control vacio , (2) gránulos de Hidroxiapatita sintética / óxido de Silicio objeto del test, (3) gránulos de Hidroxiapatita xenogénica (4) gránulos de hidroxiapatita sintetica / óxido de Silicio objeto del segundo test. Los resultados de estos últimos gránulos no han sido reportados puesto que su tamaño era tres veces mayor que la de los otros dos materiales. A las 4 semanas, los animales fueron sacrificados y se obtuvieron una secciones descalcificadas para su análisis histológico. Se utilizó el test Kruskal-Wallis para el estudio estadístico (po0.05).

RESULTADOS
El análisis histomorfométrico mostró una fracción media del área de hueso formado nuevo de 12.32+-10.36% para el grupo control vacio, 17.47+-6.42% para el grupo de gránulos de hidroxiapatita xenogénica y 21.2+-5.32% para el grupo de los gránulos de hidroxiapatita sintética/ óxido de Silicio. Basándose en la sección del medio, los puentes óseos de nueva formación en el defecto fueron de 38.33+-37.55% en el grupo control vacío, 54.33+-22.12% en el grupo de gránulos de hidroxiapatita xenogénica y de 79+-13.31% en el grupo de los gránulos de hidroxiapatita sintética/ óxido de Silicio. El contacto del sustituto óseo a hueso fue de 46.38+-18.98% para el xenogénico y de 59.86+-14.92% para el grupo de la hidroxiapatita sintética / óxido de Silicio. No existen diferencias significativas en términos de formación ósea y de puentes sobre el defecto que puedan ser detectadas entre los dos materiales de sustitución ósea y el defecto vacío.
CONCLUSIÓN
Existe evidencia que los gránulos de hidroxiapatita sintética / óxido de Silicio proporcionan resultados comparables al mineral de hueso bovino xenogénico standard en términos de formación ósea y de puentes sobre defectos de tamaño no crítico.